این واکنش مورد مطالعه قرار گرفته و ثابت گردیده است که از معادله ی درجه ی دوم تبعیت می کند و از این رو معادله ی سرعت آن به شکل زیر است :
dX / dt = K2 (a-X)(b-X) -2
که در آن :
t : مدت زمانی که از شروع واکنش گذشته است .
X : مقدار مول بر لیتری که در زمان t ترکیب شده است .
a : غلظت اولیه ی CH3COOC2H5 بر حسب مولار .
b : غلظت اولیه ی -OH بر حسب مولار .
در صورتیکه a=b باشد معادله ی 2 به شکل زیر در می آید
dX / dt = K2 (a-X)2 -3
از انتگرال گیری در معادله ی 2 و 3 خواهیم داشت :
Ln { b( a-X )/a ( b-X ) = K2 ( a-b )t a =/= b -4
X/ ( a-X ) = K2 at a == b -5
در بررسی سینتیک این واکنش مسئله ی مهم این است که مقادیر X در زمان های مختلف و در دما های ثابت اندازه گیری شود و چون با پیشرفت واکنش و جابجا شدن یون -OH با یون -CH3COO در محیط ، بر مقاومت الکتریکی محلول افزوده می شود می توانیم هدایت الکتریکی محلول را در زمان های مختلف با استفاده از یک کنداکتیو متر اندازه گیری کنیم و از آنجا پیشرفت واکنش را مورد بررسی قرار دهیم ، پس در این مورد X تابعی از هدایت الکتریکی است که باید آنرا پیدا کرد .
در حالت a=b ، برای محاسبه ی X از داده های هدایت الکتریکی می توان از روابط زیر استفاده کرد :
که در آن :
Go : هدایت الکتریکی NaOH رقیق شده به غلظتی که معادل مقدار آن در مخلوط اجسام موثر در آغاز آزمایش (هدایت الکتریکی استات اتیل خالص ناچیز است )
Gt : هدایت الکتریکی مخلوط واکنش (1) پس از گذشت زمان t
Gc : هدایت الکتریکی مخاوط واکنش موقعی که به حالت کامل رسیده است .
C : غلظت اولیه ی اجسام حاصل a=b=c و

،

به ترتیب هدایت های اکی والان یونی -OH و -CH3COO می باشند .
از تقسیم دو رابطه ی 6 و 7 به همدیگر خواهیم داشت :
X/C = ( Go - Gt ) / ( Gt - Gc) -8
و از تلفیق رابطه ی اخیر با رابطه ی 5 بدست می آوریم :
Go - Gt ) / ( Gt - Gc ) = K2at -9
و یا
Go - Gt ) / t = K2 (Gt - Gc) -10)
طبق رابطه ی 10 از رسم تغییرات Go - Gt ) / t ) در مقابل تغییرات Gt می توان خطی بدست آورد و از روی شیب آن که K2a است K2 را محاسبه نمود .
از طرفی با اندازه گیری K2 در دو دما و بکار بردن معاله ی زیر
می توان دلتا H استار ( تغییرات آنتالپی استاندارد تشکیل کمپلکس فعال که از مواد موثر حاصل می شود ) را تعیین نمود ، رابطه ی اخیر با فرض ثابت بودن دلتا H* در دما های نزدیک بهم نوشته شده است . در این آزمایش K2 را در دماهای 25C و 35C تعیین می کنیم .
امیدوارم تو انتگرال گیری مشکلی نداشته باشید ، من نحوه ی انتگرال گیری رو نذاشتم و فقط جواب آخر رو قرار دادم ، 
منبع :: سایت علمی نخبگان جوان
نویسنده :: *مینا*







 پاسخ با نقل قول
پاسخ با نقل قول



 و
و  را به صورت تکی تعیین نمود زیرا آنها همواره با همدیگر و یا با یون دیگری همواره می باشند ، بدین جهت ضریب فعالیت یونی متوسط
را به صورت تکی تعیین نمود زیرا آنها همواره با همدیگر و یا با یون دیگری همواره می باشند ، بدین جهت ضریب فعالیت یونی متوسط  به صورت زیر تعیین می شود ::
به صورت زیر تعیین می شود :: 
 بدست آمده می توان
بدست آمده می توان  عموما تغییرات
عموما تغییرات 



 بر حسب
بر حسب  بایستی خط راستی با شیب
بایستی خط راستی با شیب  و عرض از مبدا
و عرض از مبدا 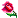

 و b مقدار ثابتی هستند در غلظت های پایین تغییرات
و b مقدار ثابتی هستند در غلظت های پایین تغییرات  بر حسب
بر حسب خطی است مستقیم به ازای C= 0 مقدار
خطی است مستقیم به ازای C= 0 مقدار 







 مشخص گردیده و K الکترولیت بدست می آید .
مشخص گردیده و K الکترولیت بدست می آید .


 ،
،  به ترتیب هدایت های اکی والان یونی -OH و -CH3COO می باشند .
به ترتیب هدایت های اکی والان یونی -OH و -CH3COO می باشند .







علاقه مندی ها (Bookmarks)